No entanto, novas evidências laboratoriais sugerem que o revestimento intestinal pode estar a desempenhar um papel muito maior do que pensávamos.
Investigadores recriaram em laboratório as etapas iniciais da resposta ao glúten. O trabalho desvia a atenção da alimentação isolada para as células que revestem o intestino delgado, que aparentam dar início à cascata imunitária. Esta descoberta direciona o pensamento sobre tratamentos do evitamento total para intervenções mais direcionadas na origem do problema.
Quando o glúten leva o corpo a atacar-se a si próprio
A doença celíaca afeta cerca de uma em cada cem pessoas em todo o mundo. Para estas pessoas, trigo, cevada e centeio desencadeiam uma reação imune que danifica o intestino delgado. As vilosidades em forma de dedo, que absorvem os nutrientes, tornam-se achatadas. Com o tempo, a absorção de ferro, cálcio e vitamina B12 diminui. Isso pode levar a anemia, osteoporose e problemas neurológicos.
O quadro é confuso. Existem mais de 200 sintomas relatados, e muitas pessoas sentem-se bem durante anos enquanto o intestino vai sendo danificado de forma silenciosa. Uma dieta rigorosamente isenta de glúten continua a ser a única gestão comprovada a longo prazo. Mesmo assim, pequenas exposições podem ocorrer. Uma migalha numa tábua de cortar. Um molho mal rotulado. Seguem-se crises.
A dieta protege muitas pessoas com doença celíaca. Não explica totalmente porque começam as reações, nem porque é que doses ínfimas podem reacender a inflamação.
O que mostra realmente a nova investigação
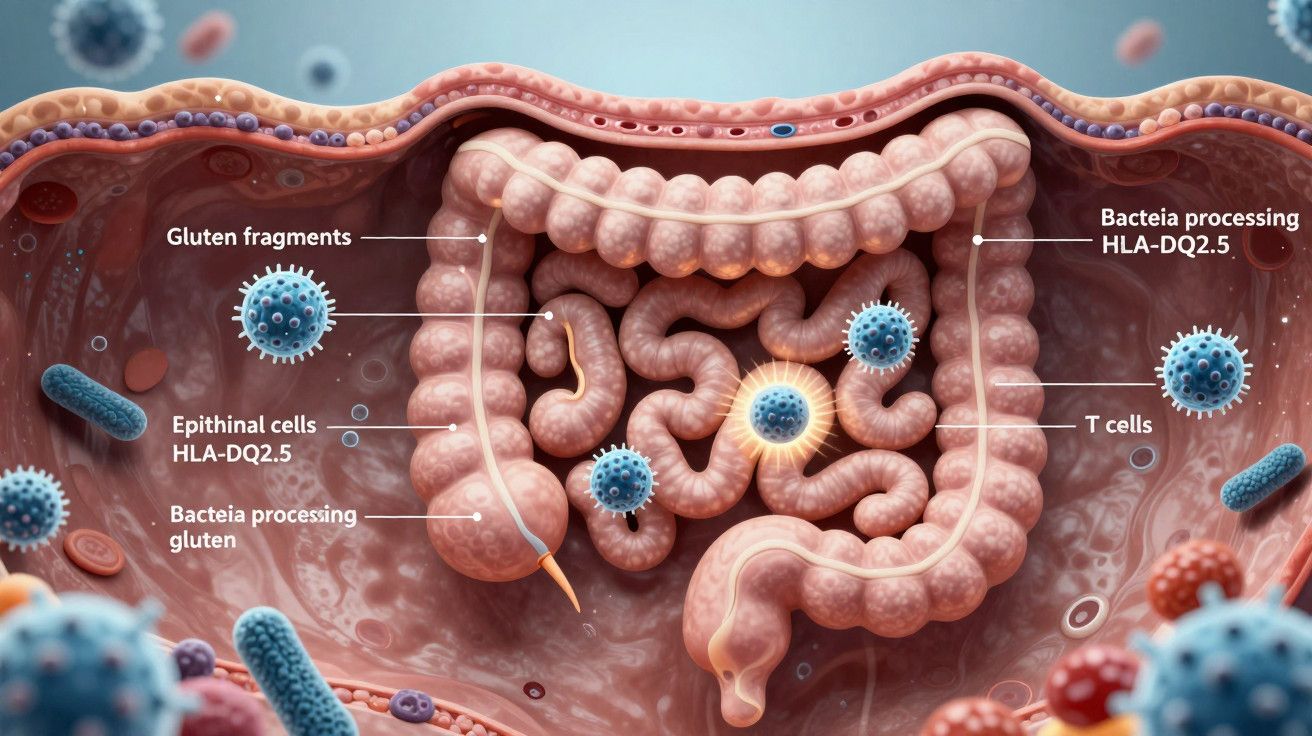
Uma equipa liderada pela Universidade McMaster relata um passo inicial crucial na cadeia de eventos. Utilizando organoides intestinais cultivados a partir de ratinhos modificados com o gene de risco humano HLA-DQ2.5, os investigadores simularam o revestimento intestinal. Testaram como estas células lidam com fragmentos de glúten em condições inflamatórias.
Como foram organizadas as experiências
Organoides são modelos vivos em miniatura que imitam a estrutura e função do intestino. A equipa alimentou-os com diferentes preparações de glúten. Algumas foram degradadas por enzimas bacterianas. Outras permaneceram intactas. Depois registaram como as células epiteliais—que formam a superfície interna do intestino—processaram e apresentaram os fragmentos de glúten ao sistema imunitário.
O resultado foi surpreendente. Estas células epiteliais não permitiram apenas que os peptídeos do glúten atravessassem. Elas empacotaram-nos e apresentaram-nos via moléculas HLA de uma forma que desperta as células T reativas ao glúten. Isso coloca o revestimento intestinal como um interveniente ativo, e não uma barreira passiva.
O epitélio intestinal pode apresentar peptídeos de glúten através do HLA e ativar diretamente as células T—criando uma ponte causal clara para a inflamação.
O estudo sublinhou ainda o papel dos microrganismos. Quando certas bactérias, incluindo Pseudomonas aeruginosa, pré-digeriam o glúten, os peptídeos resultantes tornavam-se mais facilmente reconhecidos pelo sistema imunitário neste modelo. Paralelamente, enzimas humanas como a transglutaminase tecidular podem modificar peptídeos do glúten, tornando-os mais compatíveis com o HLA-DQ2.5 ou HLA-DQ8. Em conjunto, estes passos afinam o alvo imunitário.
Porque é que o revestimento do intestino é importante
O intestino delgado é ao mesmo tempo filtro e fiscal. Absorve nutrientes enquanto controla o que chega aos tecidos mais profundos. As células epiteliais têm sensores de padrões. Comunicam com as células imunitárias da lâmina própria. Se essas células epiteliais apresentarem ativamente antigénios do glúten, podem definir o tom para toda a resposta imunitária. Isso pode explicar porque é que algumas pessoas reagem tão fortemente a exposições mínimas e porque a inflamação pode persistir apesar das dietas rigorosas.
- O epitélio intestinal é um interveniente ativo na apresentação de antigénios do glúten.
- O processamento bacteriano pode tornar os fragmentos de glúten mais imunogénicos em contexto experimental.
- Genes de risco HLA moldam a força com que estes fragmentos são apresentados às células T.
- Eventos precoces no revestimento podem determinar a dimensão dos danos subsequentes.
Rumo a tratamentos que acalmem o intestino sem eliminar o glúten
Se o revestimento apresenta o desafio ao sistema imunitário, então a terapêutica poderá suavizar essa transmissão. Várias vias parecem agora plausíveis. Uma ideia é limitar o transporte e a modificação dos peptídeos do glúten através das células epiteliais. Outra é modular a apresentação do HLA na superfície epitelial. Uma terceira é alterar o microbioma para afastar bactérias que potenciem fragmentos imunogénicos.
Algumas estratégias já estão em fase avançada de teste e podem articular-se com esta abordagem. Moduladores das tight-junctions visam reduzir a permeabilidade entre células. Enzimas orais degradadoras de glúten tentam dividir as proteínas em fragmentos inofensivos antes de chegarem ao intestino delgado. Polímeros sequestradores prendem o glúten no intestino. Ensaios de tolerância do tipo vacinação tiveram resultados mistos, mas o conceito mantém-se vivo com abordagens mais direcionadas.
| Abordagem | Alvo | Status | O que esperar |
| Moduladores das tight-junctions (ex: via da zonulina) | Permeabilidade paracelular | Ensaios clínicos concluídos ou em curso | Pode reduzir reações acidentais; efeito varia consoante o paciente |
| Glutenases orais | Digestão dos peptídeos do glúten | Resultados mistos em ensaios | Melhor para exposições de baixa dose; não permite uma dieta normal |
| Bloqueadores da apresentação de antigénios | Apresentação de HLA-peptídeo em células epiteliais ou imunológicas | Conceitos pré-clínicos em expansão | Poderá prevenir a ativação das células T na origem |
| Modulação do microbioma | Enzimas e equilíbrio de espécies bacterianas | Estrategias iniciais e dietéticas | Potencial para reduzir a carga de peptídeos imunogénicos |
A mudança é do evitamento absoluto para o controlo preciso do ponto de ignição dentro do revestimento intestinal.
Isto não significa que celíacos possam desleixar a dieta amanhã. Indica sim um caminho onde a medicação reduz o impacto da contaminação e onde a tolerância pode melhorar. Como salienta a gastrenterologista Elena Verdú e colegas, só a dieta nem sempre restaura o revestimento intestinal ou elimina a inflamação de baixo grau em doentes sensíveis. Uma terapêutica focalizada no epitélio pode ajudar a fechar essa lacuna.
O que isto significa para quem segue uma dieta sem glúten no Reino Unido
Os critérios mantêm-se para já. No Reino Unido, “sem glúten” nos rótulos significa 20 partes por milhão ou menos. O contacto cruzado em cafés e bares permanece um risco real. A aveia é naturalmente isenta de glúten, mas muitos produtos estão contaminados a menos que sejam certificados. Algumas pessoas reagem também à avenina, a proteína da aveia, por isso a tolerância varia.
Testar continua a ser importante. Quem suspeita de doença celíaca deve continuar a consumir glúten até fazer análises ao sangue e biópsias. Retirar o glúten precocemente pode mascarar o diagnóstico e atrasar uma confirmação. Familiares diretos de portadores de doença celíaca têm maior risco e podem beneficiar de rastreio.
Perguntas que continuam em aberto
Organoides laboratoriais são uma ferramenta poderosa, mas não equivalem a um intestino humano completo. Estudos maiores em pessoas devem confirmar como ocorre a apresentação epitelial na vida real. É também importante mapear que espécies bacterianas tornam o glúten mais imunogénico em diferentes indivíduos. Dieta, antibióticos e infeções podem influenciar esse equilíbrio.
Outra questão em aberto é a sensibilidade ao trigo não-celíaca. Muitas pessoas relatam sintomas sem apresentar autoimunidade clássica ou danos nas vilosidades. Alguns mecanismos podem sobrepor-se, como disfunções de barreira e desencadeamento da imunidade inata, mas a coreografia imunitária pode diferir. Um enfoque no revestimento pode ajudar a distinguir estas condições e evitar tratamentos excessivos.
Perspetivas práticas e ensinamentos úteis
- A doença celíaca está fortemente ligada ao HLA-DQ2.5 e HLA-DQ8, mas só os genes não a causam.
- O revestimento intestinal pode apresentar antigénios e definir o tom imunitário, especialmente sob stress inflamatório.
- O processamento bacteriano molda o conjunto de peptídeos do glúten. Dieta e antibióticos podem mudar essa composição.
- Medicamentos futuros poderão tornar as migalhas acidentais menos perigosas, sem substituir uma dieta cuidadosa.
Onde a precisão pode ser útil no futuro
Pense num plano por camadas. Enzimas cortam o fornecimento do combustível. Agentes das tight-junctions limitam as fugas. Medidas para o microbioma mudam a “receita” dos peptídeos. Bloqueadores da apresentação epitelial desligam a faísca. Juntar efeitos modestos de várias camadas poderá dar proteção significativa no dia-a-dia.
Há dilemas a gerir. Suprimir a apresentação de antigénios tem de evitar efeitos colaterais no sistema imunitário global. Ferramentas para o microbioma têm de ser específicas, não generalistas. As enzimas precisam de funcionar na química agressiva do estômago. São problemas de engenharia solucionáveis, mas exigem tempo, doses cuidadas e os grupos de doentes certos.
Última nota de contexto para doentes e familiares
A doença celíaca frequentemente coexiste com outras doenças autoimunes, como diabetes tipo 1 e doença autoimune da tiroide. Isto complica os planos de nutrição e medicação. O novo foco epitelial pode ajudar ao reduzir o efeito inflamatório do intestino. Um melhor controlo ao nível do revestimento pode significar reservas de ferro mais estáveis, ossos mais fortes e menos dias de fadiga “misteriosa”.
Até chegarem novos tratamentos, os pequenos hábitos compensam. Ler rótulos. Evitar torradeiras partilhadas. Levar um cartão para restaurantes. A investigação está a virar-se para a linha da frente do intestino. Isso, pelo menos, dá às próximas terapêuticas um alvo claro a atingir.




Comentários (0)
Ainda não há comentários. Seja o primeiro!
Deixar um comentário